@sivarihoca Kimyasal enerjinin elektrik enerjisine dönüştürülebildiğini önceki bölümde açıkladık. Enerjinin dönüş-
türülebilmesi ilkesine göre elektrik enerjisi de kimyasal enerjiye dönüştürülebilir. Kimyasal enerjinin
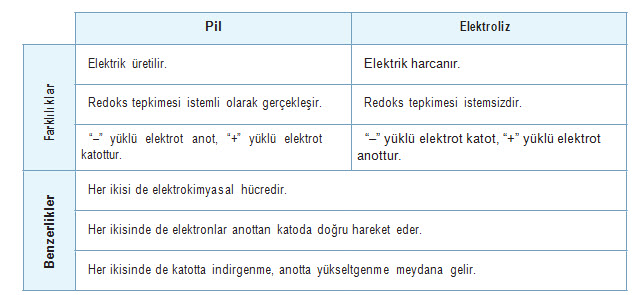
elektrik enerjisine, elektrik enerjisinin kimyasal enerjiye dönüştürülebilmesine imkân sağlayan sistem-lere elektrokimyasal hücreler denir.
.Elektrokimyasal hücreler genel olarak ikiye ayrılır:
1) Kimyasal enerjiyi elektrik enerjisine dönüştüren Voltaik hücreler olarak da bilinen Galvanik hücreler (pil)
2) Elektrik enerjisini kimyasal enerjiye dönüştüren elektrolitikhücreler (elektroliz sistemi)
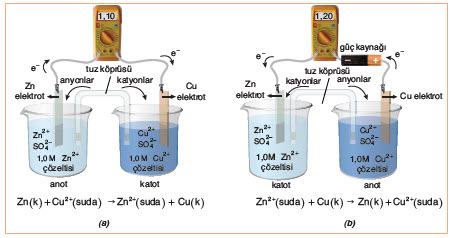
Galvanik hücreler, istemli olarak gerçekleşen redoks tepkimeleri sonucunda elektrik enerjisi üreten sistemlerdir. Bir galvanik hücre oluşturmak için bir çinko (Zn) metali, çinko sülfat çözeltisine ve bir bakır (Cu) metali, bakır (II) sülfat çözeltisine daldırılır. Temel olarak bu Galvanik hücrede gerçekleşen iyonla-rının indirgenerek metalik Cu’a dönüşümüdür. İndirgenme ve yükseltgenme olaylarında aktarılan elektronların yer değiştirmesi, Zn ve Cu metallerini birbirine bağlayan iletken bir tel aracılığı ile sağlanır. Burada kullanılan Zn ve Cu metalleri elektrot olarak adlandırılır. Zn elektrodun daldırıldığı ZnSO4 çözeltisine veCu elektrodundaldırıldığı CuSO4 çözeltisine elektrolit adı verilir. Zn elektrodunolduğu tarafta yükseltgenme meydana gelir. Cu elektrodun olduğu tarafta indirgenme meydana gelir. Yükseltgenmenin gerçekleştiği elektrot anot, indirgenmenin gerçekleştiği elektrot katot olarak adlandırılır.
İndirgenme ve yükseltgenme yarı tepkimelerinin gerçekleştiği bölümlere yarı hücre, bu sistemin
tamamına (indirgenme ve yükseltgenmeyi aynı anda kapsayan) hücre denir. Yükseltgenme sonucu
açığa çıkan elektronlar, elektrona ihtiyaç duyulan indirgenmenin olduğu tarafa doğru, iletken tel aracılı-
ğı ile hareket eder (Elektron hareketi, anottan katoda doğrudur.). Elektronların yer değiştirmesi ile birlikte yarı hücrelerde yük denkliği bozulur. Elektron hareketinin sürekli olması için yük denkliğinin de sağ-
lanması gerekir. Yük denkliğinin sağlanmasında içinde tuz çözeltisi bulunan U şeklinde cam bir boru kullanılır. Buna tuz köprüsü denir .
Anot yarı hücresinde, metalik Zn’nun Zn2 + iyonlarına dönüşmesiyle birlikte Zn elektrodun zamanla aşındığı gözlemlenir. Katot yarı hücresinde ise Cu2+ iyonları metalik Cu’a indirgendiği için Cu elektrodun çevresi Cu metali ile kaplanır (Görsel 1.11.b).
Zn Cu Galvanik hücresindeki elektrolit çözeltilerin 1 atm basınçta 25°C’ta Galvanik hücrenin ürettiği elektrik enerjisi, voltmetre ile yaklaşık 1,1 volt olarakölçülür (Görsel 1.12.a). İstemli olarak gerçekleşen bu olayı tersine döndürmek için ise enerji gereklidir. Eğer aynı sisteme 1,1 volttan daha büyük akım üreten bir güç kaynağı, Görsel 1.12.b’deki gibi voltmet- renin yerine bağlanırsa Galvanik hücredeki olayların tersi gerçekleşmeye başlar. Zn elektrodun olduğu taraf katot, Cu elektrodun olduğu taraf anottur. Elektronların hareket yönü Cu elektrottan Zn elektroda doğru iken anyonlar Cu elektroda, katyonlar Zn elektroda doğru hareket eder. Elektrolitik hücreler, kendiliğinden gerçekleşmeyen (istemsiz) redoks tepkimelerinin elektrik enerjisi kullanılarak gerçekleştirilmesini sağlar. Bu işleme elektroliz adı verilir.
Elektroliz; uygun Galvanik hücrelerin yani pillerin şarj edilmesi, alüminyum metalinin elde edilmesi, bir objenin krom ile kaplanması gibi günlük yaşamda kullanım alanlarına sahiptir.
Elektrolitik sistemlerde elektrotların yükleri Galvanik hücrenin tam tersi olur. Elektrokimyasal hücre-
lerde her zaman inert elektrotlar kullanılmaz. Bazı redoks tepkimelerinde özellikle elektrotların tepkime
de yer alması, elde edilecek ürün açısından gerekli olabilir. Örneğin bakır (II) sülfat çözeltisinin elektro-
lizi, bakır metalinin saflaştırılmasında kullanılan bir yöntemdir ve elektrotların redoks tepkimesine katıl
maları gerekir. Bu yöntem sonraki bölümlerde daha ayrıntılı açıklanacaktır.